
Мамченко А.В., Герасименко Н.Г., Дешко И.И., Пахарь Т.А.
Институт коллоидной химии и химии воды НАН Украины, г. Киев
Фтор – один из наиболее реакционно-активных химических элементов и поэтому встречается на земной поверхности не в индивидуальном состоянии, а исключительно в виде соединений. Фтор широко распространен в природе и находится в минералах, рудах, почвах, атмосфере, природных водах, растительных и животных организмах (1-11). К наиболее распространенным фторсодержащим минералам относятся: селлаит (MgF2) – 61%; виллиомит (NаF) – 55%; флюорит (CaF2) – 49%; криолит (Na3AlF6) – 45%; бастнезит ((Ce, La) (CO3)F) – 9%; фторапатит (Са3(РО4)3F – 3-4% и др. (2, 4, 11). Повсеместное распространение растворимых фторсодержащих соединений в породах и почвах обусловливает наличие фтора в природных и подземных водах, используемых для питьевого водоснабжения. Известно, что в морской воде количество фтора находится на уровне 1,0 мг/дм3, а в большинстве поверхностных источников (реках, озерах, водохранилищах) оно значительно меньше и колеблется в пределах 0,3-0,5 мг/дм3 (1-5). Более высокое содержание фтора в некоторых поверхностных водоемах может быть следствием либо географического местонахождения, либо загрязнения техногенного или антропогенного происхождения. В подземных водах природная концентрация фтора изменяется от средних значений 1-15 мг/дм3 до очень высоких 35-50 мг/дм3 и зависит от геологических, химических и физических характеристик водоносного слоя, пористости и кислотности почвы и камней, температуры, действия присутствующих химикатов и т.д. (2-5, 7).
Доля подземных вод, служащих источником питьевого водоснабжения в разных странах, зависит от их обеспеченности водными ресурсами и качества последних. В разных государствах мира она различна и для некоторых значительна: Япония – 5%; Украина – 15-18%; США – 25%; ФРГ – 71%; Индия – 85% и т.д. (1-5, 9-11).
Обычно для централизованных систем питьевого водоснабжения используются мало минерализованные, бактериально чистые, отвечающие требованиям стандартов на питьевую воду, артезианские воды, подаваемые потребителю без очистки. Но в последнее время во всем мире в результате хозяйственной деятельности человека ухудшается качество не только поверхностных, но и естественно защищенных подземных вод.
Одним из показателей качества питьевой воды является содержание в ней фтора. Результаты многочисленных исследований свидетельствуют как об отрицательном, так и положительном влиянии фтора на организм человека (2, 4, 9, 10). Попадая в организм животных и человека, фтор вызывает такие необратимые заболевания как зубной и скелетный флюороз, оказывает токсическое воздействие на сердечно-сосудистую и центральную нервную систему, а также на работу печени, почек, щитовидной железы. В то же время при использовании питьевой воды с низким содержанием фтора наблюдается заболевание кариесом.
Согласно последним требованиям ВОЗ содержание фтора в питьевой воде должно находиться в пределах 0,5-1,0 мг/дм3 (12). В силу социально-экономических и географических причин в разных странах предельно допустимые концентрации фтора в питьевой воде колеблются вблизи этого диапазона: США – 0,6-0,9 мг/дм3 (2); Индия – 1,0-1,5 мг/дм3 (4); Украина – 0,7-1,5 мг/дм3 (6). Как отмечают авторы (2-5, 11), использование подземных источников для питьевого водоснабжения более чем в 20 развитых и развивающихся странах невозможно без удаления избыточных концентраций фтора. Проблема обесфторивания подземных вод, используемых для питьевого водоснабжения, актуальна и для Украины, поскольку количество фтора в её подземных источниках составляет в среднем 2,5-5,0 мг/дм3, достигая в некоторых областях, например в Полтавской (6), и более высоких значений (до 12 мг/дм3).
Все методы (2, 4, 5, 11), которые в той или иной степени, обеспечивают извлечение ионов фтора из воды поверхностных и подземных источников, можно разделить на четыре группы: осаждение и соосаждение (13-28); сорбционные (21,29-65); ионообменные (18, 66-71) и физико-электрохимические (72-97). В последнюю группу входят электрокоагуляция и мембранные методы: электродиализ, нанофильтрация и обратный осмос. Такое деление довольно условно, поскольку один и тот же механизм извлечения фтора и реагенты, ответственные за данный процесс, могут относиться к разным методам.
■ МЕТОДЫ ОСАЖДЕНИЯ И СООСАЖДЕНИЯ
Реагентами, наиболее часто используемыми в методах осаждения, являются соли кальция, магния, алюминия, железа, фосфатные соединения и др. Удаление фтора из воды обусловлено либо осаждением его в виде малорастворимых основных солей, либо сорбцией этих ионов на активных осадках соответствующих гидроксидов (2, 5, 11, 13-28).
Если содержание фтор-иона в исходной воде более 12-15 мг/дм3, то целесообразно провести предварительное известкование (не менее 1,5 мг оксида кальция на 1 мг фтора), позволяющее связать основную часть фтора во фторид кальция. Низкая растворимость Са(ОН)2 обусловливает большой расход реагента, поэтому чаще применяют либо смесь извести с хорошо растворимым хлористым кальцием, либо только последний (13-15). Однако, известкованием нельзя обеспечить требуемой для питьевой воды степени очистки из-за относительно высокой растворимости CaF2 (при 20ОС концентрация фтора 7,7 мг/дм3).
Метод осаждения – коагуляции, обеспечивающий извлечение фтора свеже сформированными осадками гидроксидов магния, алюминия, железа и трикальций фосфата, экономически выгодно использовать для поверхностных вод, осветляемых перед подачей в сеть, хотя в некоторых случаях их применяют и для подземных вод (2, 16-23). Для удаления 1 мг фтора (5, 14) требуется в среднем 2 мг-экв/дм3 солей магния (хлорид или сульфат магния и известь); 30 мг трикальцийфосфата (известь и ортофосфорная кислота) и 30-35 мг Al2O3 для сульфата алюминия, сода или известь для необходимого щелочного резерва. Коагуляцию желательно проводить во взвешенном слое. Окончательная доочистка воды завершается на фильтрах с различной загрузкой.
Широкое применение для обесфторивания подземных вод Индии, содержащих до 30 мгF/дм3, получил разработанный на основании многолетних исследований метод Nalgonda (16-21). Эта технология включает ряд процессов: смешение воды с коагулянтом (солями алюминия), известью (содой) и белильной известью; седиментацию коагулированной взвеси не менее 2-4 ч и фильтрацию через песчаные фильтры. Выбор соли алюминия (хлорида или сульфата) зависит от содержания этих анионов в исходной воде, чтобы не допустить превышения их допустимых пределов. Расход коагулянта определяется содержанием фториона и составляет в среднем 30 мг Al2O3/мг F. Добавление извести (или соды) гарантирует адекватную щелочность для эффективного протекания гидролиза коагулянта и предотвращения роста содержания остаточного алюминия в питьевой воде. Процесс удаления фторионов протекает по реакциям:
2Al3+ + 6H2O → 2Al(OH)3 + 6H+ (1)
F- + Al(OH)3 → Al-F complex + продукт неопределенного состава (2)
6Ca(OH)2 + 12H+ → 6Ca2+ + 12H2O (3)
Помимо фторидов (до 1,5 мг/дм3) удаляются мутность, цвет, запах, пестициды и органические вещества, микроорганизмы. Метод нашел применение для обесфторивания подземных вод в Кении, Танзании, Китае и ряде других стран (2, 4, 11, 20).
Для обеспечения населения небольших сельских общин качественной питьевой водой разработан метод IISc, который состоит в обработке воды окисью магния (в виде разбуренной породы), гидроксидом кальция и бисульфатом натрия (23). Извлечение фтора протекает протекает по реакциям:
MgO + H2O → Mg(ОН)2 (4)
2NaF + Mg(ОН)2 → MgF2 + 2NaOH (5)
Установлено, что для подземных вод с содержанием фториона от 2 до 5 мг/дм3 расход окиси магния составляет 0,8 г/дм3 при концентрации бикарбонатных ионов < 200 мг/дм3. Повышение содержания последних обусловливает введение гидроксида кальция (0,3 г/дм3). Поскольку процесс протекает при рН=10-11, для снижения его до необходимого интервала (6,5-8,5) предусмотрена стабилизация очищенной воды посредством бисульфата натрия (от 0,15 до 0,20 г/дм3). Рассмотренный метод обеспечивает высокую эффективность очистки (~80%) и применим для обесфторивания подземных вод с содержанием фтор-ионов 2-20 мг/дм3. Предложено использование образующегося при этом коагулята для фторирования вод, содержащих ниже 0,7 мгF/дм3 (28).
Изучена возможность использования метода осаждения для обесфторивания подземной воды с содержанием 6,00±0,59 мг/дм3 фтора (Эстония) (21). Необходимая степень очистки до 1,5 мг F/дм3 с одинаковой эффективностью обеспечивается при расходе 25-30 мг Al2O3/мг F как кристаллического, так и жидкого сульфата алюминия (ALS, Кемира), что практически совпадает с данными других авторов (4, 5, 16-18).
С развитием технологий получения высоко эффективных коагулянтов полиоксисульфатов (PAHS) и полиоксихлоридов (PAC) алюминия стало возможным использование их в качестве реагентов в процессах обесфторивания. При этом снижается расход не только коагулянта (в среднем на 25-30%) в сравнении с сульфатом алюминия, но и щелочных реагентов (извести, соды), а также улучшается процесс седиментации и отстаивания. Установлена эффективная сорбция ионов фтора матрицей активного гидроксида алюминия, формирующегося в процессе гидролиза полигидроксосолей алюминия, вследствие соразмерности ионов фтора и гидроксила (21, 22).
Разработан реагентный метод (24), который позволяет при меньших временных затратах обеспечить степень очистки воды от фтор – ионов более 98%. Процесс включает две стадии: предобработку известью и обработку воды реагентом HYCOR FL в контролируемом диапазоне рН=7,5-7,8. Реагент HYCOR FL – это смесь нерастворимого оксида алюминия и растворимой комплексной соли алюминия (рН 1,2-2,7). Для получения быстро седиментирующих флокул целесообразно применение раствора анионного полимера HYCRAM A 760. Использование HYCOR FL позволяет удалить фтор-ионы до концентрации менее 0,5 мг/дм3.
Целесообразно использование в качестве реагентов для обесфторивания подземных вод средних и основных солей железа (26, 27). Так, очистку грунтовых вод с содержанием фтора 25 и 50 мг/дм3 проводили с помощью оксигидроксида железа в диапазоне доз 25-50 мг/дм3 по железу. Эффективность удаления фтор-иона в оптимальной области рН=2,0-5,0 составляла в среднем 90% (27).
Рассмотренный материал (13-27) позволяет отметить преимущества и недостатки метода осаждения – коагуляции для обесфторивания воды. К преимуществам следует отнести дешевизну и доступность в исполнении, применение недефицитных реагентов. К недостаткам – неприменимость при высоком (более 10 мг/дм3) содержании фторидов, что требует большой дозы коагулянта и приводит к резкому повышению солесодержания в виде сульфат- или хлорид – ионов; опасность повышения по той же причине растворенного алюминия в питьевой воде, что недопустимо с учетом его нейрогенного воздействия на организм человека (25); необходимость регулярного анализа очищаемой воды, параметры которой изменяются в широких пределах вследствие сезонных колебаний, и точного дозирования реагентов; строгий контроль рН и щелочности питьевой воды (стабилизационная обработка).
Использование методов осаждения и соосаждения при обесфторивании воды обусловливает, как правило, необходимость следующей стадии обработки, а именно, фильтрования через различные сорбенты.
■ СОРБЦИОННЫЕ МЕТОДЫ
Перспективными для извлечения фтора из природных и подземных вод с содержанием менее 15 мгF/дм3 являются методы, основанные на сорбционных процессах с использованием фтор-селективных материалов как природного, так и искусственного происхождения. Широкое применение в процессах обесфторивания получили следующие материалы: активированный оксид алюминия (21, 29-39); фосфатсодержащие (2, 5, 14, 40-46), глинистые и почвенные (11, 40, 45-57), магнезиальные (5, 11, 14, 23) сорбенты; активированные угли (4, 5, 11,58-60) и другие (61-65).
Активированный оксид алюминия (АОА) – это гранулированный, пористый материал с высокой удельной поверхностью порядка 200-300 м2/г. АОА в процессе извлечения фтор-ионов действует как анионит, поверхность которого насыщена различными в зависимости от природы активатора адсорбционными центрами: ОН-, Cl-, SO42- (29-33).
[AOA]2SO4 + 2F– → 2[AOA]F + SO42- (6)
[AOA]2SO4 + 2НСО3- → 2[AOA]НСО3 + SO42- (7)
Эквивалентно увеличению сульфат-ионов в обрабатываемой воде происходит уменьшение суммарной концентрации в ней бикарбонатных и фтор-ионов. При этом, как показано в (33), суммарная рабочая обменная ёмкость АОА по НСО32- и F- составляет ~250 мг-экв/м3, из них по фтору всего ~47 мг-экв/м3. В случае насыщения поверхности АОА гидроксильными группами, вследствие обмена последних на ионы фтора, повышается рН. Таким образом, эффективность сорбции фтор-ионов на АОА падает с повышением рН и щелочности воды. Наибольшая сорбционная ёмкость АОА по отношению к фтору наблюдается для рН=5,0-6,0 при степени очистки более 95% (14, 31). Однако, авторы (30) указывают, что оптимум сорбционной ёмкости АОА находится при рН=3,0 и ниже. Поскольку в начальный период фильтрования остаточное содержание фтор-ионов близко к нулю, фильтрат смешивают с исходной водой до СF=1,0-1,2 мг/дм3. Быстрое насыщение поверхности сорбента и снижение эффективности процесса извлечения фтор-ионов наблюдается с ростом их концентрации и скорости потока (29-36).
Исследован процесс удаления фтора сорбцией на АОА (сферические гранулы размером 2-5 мм) с удельной поверхностью 250 м2/г при исходном содержании фтор-иона – 2,5-14,0 мг/дм3 (37). При скорости потока 30 см3/мин и оптимальном рН=6,75 эффективность извлечения составила ~70%. Обнаружено, что сорбционная ёмкость АОА снижается с 0,80 до 0,36 г F/кг при уменьшении исходной концентрации фтор-иона с 7,5 до 2,7 мг/дм3 (время экспозиции 3,5 ч).
Установлено (14, 29, 31), что сорбционная ёмкость зависит от природы регенерантов и составляет 1,15 кг/м3 и 1,37 кг/м3 соответственно при последовательной обработке сорбента гидроксидом натрия и соляной кислотой либо смесью кислот и кислых солей, достигая максимального значения 2,5-3,0 кг/м3 при использовании раствора сульфата алюминия.
Присутствие железа, солей жёсткости, кварца может приводить к ухудшению извлечения фтора. Так, относительно низкую сорбционную ёмкость АОА, в сравнении с данными (36), авторы (21) связывают, в основном, с высоким содержанием ионов железа (1,12±0,36 мг/дм3) в подземной воде и формированием плёнки оксида железа на поверхности зерен загрузки в процессе фильтрации.
Для удаления фтора из питьевой воды исследован потенциал нового сорбента МОСА, способ приготовления которого состоит в обработке оксида алюминия с размером частиц от 0,5 до 0,6 мм смесью растворов 2,5М MnCl2 и 10М NаOH и двухстадийном нагревании: 150ОС, 5 ч и 500ОС, 3 ч (38). В результате на поверхности отмытого АОА образуется темная плёнка МnО2. Изучение сорбции ионов фтора на АОА и МОСА, проведенные в статических и динамических условиях показали: оптимальное удаление фторидов происходит при рН=4-7; скорость сорбции и ёмкость МОСА намного выше, чем у АОА; МОСА эффективно регенерируется 2,5% NаOH максимальная ёмкость по иону фтора на МОСА и АОА составляет 2,85 и 1,08 мг/г соответственно; для обоих сорбентов большое влияние на сорбционную ёмкость в изоэлектрической точке оказывает высота слоя. Полученные результаты свидетельствуют о явном преимуществе МОСА в сравнении с АОА при обесфторивании воды.
Получен новый фильтрующий материал для удаления фторидов ТАБ – термоактивированный боксит, обогащенный титаном (39). Максимальное извлечение фторионов, равное 3,8 мгF/г, наблюдалось в области рН=5,5-6,5 при времени контакта около 90 мин. Исходная вода содержала 1 г/дм3 и 10 мг/дм3 F-. Наличие традиционно присутствующих ионов в очищаемой воде практически не влияло на поглотительную способность ТАБ, что свидетельствует о его высокой селективности. Адсорбционная ёмкость сорбента полностью восстанавливается при обработке гидроксидом натрия (0,015 М/дм3).
Предложена новая техника модификации глинозема – активация электрическим полем (34, 35). При оптимальном режиме электроактивации (длительность около 120 мин при потенциале + 100 мВ), рН=3,5-5,0 и отношении исходной концентрации фтора к оксиду алюминия, равном 4, установлено повышение сорбционной ёмкости АОА на 50% только при высоких значениях ионной силы очищаемой воды – концентрации NаCl 800 мг/дм3 (34).
В целом, использование АОА, модифицированного различными активаторами, в непрерывном потоке является экономичным и эффективным методом обесфторивания воды, позволяющим снизить уровень фторида до 1,0 мг/дм3. Недостатком метода является существенная зависимость эффективности процесса от рН. Кроме этого, размер зерен промышленных образцов АОА 1-3 мм является причиной низкой скорости диффузии раствора внутрь частиц, что ограничивает использование сорбента для очистки больших количеств воды. Процесс можно ускорить, уменьшив размер частиц до 0,3 мм, однако возникают операционные проблемы. Кроме того, при длительной эксплуатации происходит накопление бактерий в фильтрующем слое, что приводит к более высокому, по сравнению с сырой водой, содержанию бактерий в очищенной воде (4, 11, 25, 29, 38).
В качестве эффективных сорбентов для извлечения фтор-ионов могут быть использованы обработанные щелочными растворами трикальцийфосфат (ТКФ), гидроксилапатит (ГА), суперфосфат, костный уголь и др. фосфатсодержащие материалы. Поверхность полученных при этом материалов насыщена либо гидроксильными, либо карбонатными ионами, которые замещаются на фтор-ионы в процессе фильтрования (2, 11, 14, 43, 45). Сорбционная ёмкость фосфатсодержащих материалов колеблется от 0,5 до 4,0 мг F/г. Обесфторивание целесообразно проводить в слабокислой среде, а при регенерации использовать последовательную обработку загрузки гидроксидом натрия и углекислотой. Более высокая степень извлечения фтора для сорбентов в карбонатной форме, по мнению авторов, обусловлена меньшим в процессе ионного обмена повышением рН воды.
Изучена степень удаления из природной воды ионов фтора природными и синтетическими сорбентами: закарпатским морденитом; хибинским фторапатитом; трикальцийфосфатом, а также их смесями (41). Наивысшую очистку воды до 92-94% при исходном содержании фтора 10 мг/дм3 обеспечивают ТКФ и его смеси с морденитом и апатитом (в массовом соотношении 1:1 и 1:1:1) при дозе, равной 1 г/дм3. Использование метода полного факторного эксперимента позволило авторам предположить, что эффективность сорбционного процесса для выбранных условий зависит в основном от начальной концентрации фтор-иона.
Довольно высокую сорбционную ёмкость костного угля (~4 мг F-/г) авторы (2, 5) связывают, в основном, с присутствием в его составе гидроксилапатита Ca10(PO)4(OH)2, одна или обе гидроксильные группы которого замещаются фтор-ионами. Подготовку сорбента проводят в печи при обжиге с ограниченной подачей или без воздуха. при температуре 550ОС и длительности 4 ч . Регенерация костного угля, насыщенного ионами фтора, осуществляется 1% раствором гидроксида натрия, избыток которого удаляется водой либо слабым раствором фосфорной кислоты.
Изучена эффективность синтетического гидроксилапатита (ГА), полученного обработкой технического суперфосфата щелочным раствором и высушенного при 110ОС (размер зерен 1-3 мм), при очистке воды, содержащей 5-6 мг/дм3 фтора (5, 11). Поглотительная ёмкость гидроксилапатита максимальна (6 мг F/г) в первых циклах процесса, а затем снижается до стабильной величины 3,5-4 мг/г. Повышение скорости фильтрования с 5 м/ч до 10 м/ч при высоте слоя сорбента 0,9 м приводит к резкому снижению его поглотительной способности. Несмотря на более высокую селективность гидроксилапатита по отношению к фтор-ионам, присутствие в очищаемой воде значительных количеств хлор-ионов (80-110 мг/дм3) снижает его эффективность в среднем на 20%.
Более высокая сорбционная ёмкость порядка 5,6-10,7 мг F/г установлена (46) для синтетического ГА, полученного из гидроксида кальция и фосфорной кислоты при температурном режиме 60-105ОС), что свидетельствует о существенном влиянии метода получения сорбента на его поглотительную способность.
В статических условиях в диапазоне рН=2-9 исследованы сорбционные свойства по отношению к ионам фтора гидроксилапатита, синтезированного в соответствии с (42). Показано (43), что высокую степень удаления F- из воды на уровне 97-98 % можно достичь при соотношении твердой фазы сорбента к раствору 1:100 и исходном содержании фтора 10-30 мг/дм3. Незначительное увеличение рН очищенной воды в процессе сорбции авторы (43, 44) связывают с вытеснением гидроксильных групп с поверхности ГА в результате ионного обмена с F- при образовании малорастворимого фторапатита Ca10(PO4)6]F2.
Установлены оптимальные условия проведения динамики сорбции ионов фтора на ГА, а также доказана возможность регенерации отработанного сорбента с помощью буферного раствора Na2COз•NаHCO3 при рН=9,9-10. Такой регенерант, в отличие от едкого натра (4, 5, 14), создаёт постоянное значение рН среды в области устойчивости ГА, обеспечивает одностадийность регенерации и является относительно недорогим.
Глинистые минералы, обладающие развитой поверхностью и высокой способностью к сорбции и катионному обмену, вполне могут быть использованы в процессе обесфторивания воды (11, 14, 40, 48, 49). Считается, что адсорбция F- на глинистых минералах и почвенном грунте обусловлена присутствием в них аморфных гидроксидов алюминия (4, 5, 11).
Монтмориллонит (11,45) обладает более высокой поглотительной способностью фтор-ионов в сравнении с каолинитом. Извлечение F–ионов сопровождается десорбцией с поверхности монтмориллонита ионов Cl- и NO3-. Присутствие в воде SO42- и PO43- слабо сказывается на степени удаления фтора (45, 46). Применение монтмориллонита при оптимальном рН=2,0 в процессе очистки воды, содержащей 5 и 10 мг/дм3 фтор-иона, обеспечило степень очистки, равную 94% (50).
Получены изотермы адсорбции фтора на поверхности бентонита, каолинита, а также их смесей в зависимости от рН, удельной поверхности, концентрации алюминия и природы некоторых ионообменных катионов, обусловливающих осаждение фторида, в составе глин (51). Обнаружено, что бентонит значительно превосходит каолинит по сорбционной ёмкости относительно фтор-иона, а степень извлечения F- смесями определяется массовым соотношением индивидуальных сорбентов.
Относительно невысокая поглотительная способность природных глинистых минералов, которая колеблется в диапазоне 0,2-0,5 мг F/г (45, 46, 50, 51), может быть повышена обжигом (2, 4, 11) либо предварительной химической обработкой 1%-ми растворами Na2CO3 и HCl (11, 44); алюмосодержащими реагентами (5, 14, 52); раствором хлористого натрия (54).
Максимальный эффект обесфторивания достигается при модификации бентонита 4-6% раствором сульфата алюминия (14). При этом расход модификатора в среднем составляет 23 мг/мг F-, что значительно меньше, чем при использовании сульфата алюминия в качестве коагулянта в методах осаждения (16-21).
В (14, 52) изучена возможность обесфторивания воды в динамических условиях на различных, предварительно модифицированных сульфатом алюминия, фильтрующих материалах: кварцевом песке, керамзите, сколе гранитного щебня, дробленном клиноптилолитовом туфе. При контакте алюмосодержащего реагента с клиноптилолитом происходит замещение обменных катионов Na+, Сa2+, Мg2+ на ионы алюминия (14, 52, 54). Установлено несомненное преимущество модифицированного клиноптилолита. Средняя удельная ёмкость загрузки снижается с 501 до 377 мг/дм3 при увеличении скорости фильтрования с 5 до 10 м/ч. Паралельно со снижением концентрации фтор-ионов в воде происходит изменение и других физико-химических показателей качества воды – рН, щелочности, ионов алюминия. При обесфторивании воды, считают авторы (52), в основном протекает реакция ионнообменного вытеснения с поверхности зернистой композиции (клиноптилолит – продукты гидролиза коагулянта) гидроксил- и сульфат-ионов фторионами очищаемой воды. Как и в методах осаждения, возможно, химическое взаимодействие между ионами фтора и алюминия с образованием сорбированных алюмофторидных комплексов по схеме:
Al+3 + nF– → (AlFn)3–n (8)
где n – целые числа от 1 до 6.
Данный метод использован для проектирования опытно-промышленной станции производительностью 10 тыс. м3/сут с последующим расширением до 22,6 тыс. м3/сут (52).
Проведены комплексные исследования дефторирующей способности клиноптилолита, модифицированного растворами гидроксохлорида А12(ОН)5С1 и гид- роксосульфата А1OНSO4 алюминия в сравнении с традиционным сульфатом алюминия (53). Показано, что использование в качестве активаторов поверхности основных солей алюминия интенсифицирует процесс обесфторивания воды: повышается степень очистки, увеличивается фильтроцикл и снижается остаточное содержание алюминия в фильтрате. В качестве фильтрующей загрузки для обесфторивания подземных вод предложен клиноптилолит, модифицированный основным хлоридом алюминия, обеспечивающий в оптимальном диапазоне рН= 6,0-8,5 наивысший эффект очистки (85-98%).
Следует отметить, что область применения в качестве фильтрующих материалов модифицированных глинистых сорбентов в процессах обесфторивания ограничена, так как при обработке щелочных вод происходит преимущественное образование гидроксида алюминия, хлопья которого приводят к быстрому забиванию загрузки, снижению фильтроцикла и необходимости повторного модифицирования (2, 14, 44).
Известняк и термообработанные природные материалы (кварц, полевой шпат, гетит, иллит) могут быть также использованы в качестве сорбентов для обесфторивания воды (2, 4, 11,55-57).
Глинистые и другие полезные ископаемые, обладающие поглотительной способностью по отношению к фтору, это прежде всего катионообменники, в состав которых могут входить токсичные катионы тяжелых металлов. Поэтому при использовании этих сорбентов в процессах обесфторивания питьевой воды необходимо исключить их потенциальное растворение. Также надо учитывать, что обжиг при очень высоких температурах (1200оС) приводит к резкому снижению их поглотительной способности, а неполное сжигание органического углерода может вызвать микробное загрязнение и загрузки, и воды (2, 11,44, 57).
Ряд работ посвящен изучению сорбции фтора оксидом и гидроксидом магния (5, 11, 14, 23). Отмечены факторы, указывающие на неэффективность применения данного реагента в статических условиях: высокая начальная стоимость МgО вследствие сложности подготовки и значительный расход его (~160 г/мF) для обеспечения нужной степени очистки, а также сильно щелочная среда (9,0-10,0) очищенной воды (11, 23). Невысокая ёмкость поглощения (~0,9 мг F/г) установлена для магнезиальных сорбентов и при обесфторивании в динамических условиях. Кроме этого, регенерация гидроксидом натрия лишь частично восстанавливает их первоначальную ёмкость по фтору, что требует частой замены сорбента свежим материалом и ведет к удорожанию процесса (5, 14). Отмеченные недостатки магнезиальных сорбентов ограничивают применение данного способа для обесфторивания воды.
Активированные угли являются дешевыми дефторирующими сорбентами (11, 14, 58-60). Использование этих материалов для обесфторивания воды показало, что они обладают относительно невысокой сорбционной ёмкостью, оптимум которой наблюдается в кислой области (рН=3,0-3,5). Обработка их солями алюминия повышает количество поглощенного фтора на 20-40%, но их сорбционная ёмкость при регенерации полностью не восстанавливается (5, 14). Сорбционная ёмкость углей повышается с увеличением температуры активации. При оптимальном значении температуры – 600ОС и соотношении объемов очищаемой воды и фильтрующей загрузки, равном 100, ёмкость сорбента, полученного на основе угля Eichhornia crassipes, составляет 4,0 мг F/г (58).
Исследована возможность использования активированного угля, полученного из шелухи зерен пшеницы и золы ТЭС, для обесфторивания подземной воды в г. Агра (Индия) с содержанием фтор-иона в среднем 2,1 мг/дм3 (59). Установленная при этом оптимальная доза сорбента около 20 г/дм3 обеспечила 90,7% удаления фтора.
Исследования, проводимые в последнее время, посвящены поиску новых, недорогих фильтрующих материалов, которые могли бы использоваться в процессе обесфторивания воды. В качестве таковых предлагаются сорбенты на основе титанилсульфа- та моногидрата (61), хитозана (62), целлюлозы хлопка, в которую импрегнированы катионы Fе3+ (63), гранулированного коррозионно-неустойчивого А1-Мg сплава (64), покрытого пористой плёнкой из оксидов магния и ме¬ди, и вспененного бетона (65).
■ ИОННЫЙ ОБМЕН
Известно (4, 10, 66, 67), что анионообменные смолы различной основности, поверхность которых насыщена ОН- или анионами, способны удалять из воды фтор-ионы. Наибольшая ёмкость присуща анионитам, содержа¬щим четвертичную аминогруппу. Процесс обмена, вследствие более высокой электроотрицательности F-, протекает по реакции:
Matrix-NR3+Cl– + F– → Matrix-NR3+F– + Сl- (9)
В начале процесса фильтрования через анионитовый фильтр практически весь фтор задерживается загрузкой, поэтому до 1,2 мг F–/дм3 фильтрат разбавляют исходной водой. Повышение содержания фтора в фильтрате более ПДК свидетельствует об окончании цикла. Смолу отмывают пересыщенным раствором хлорида натрия или соляной кислотой.
Проведена сравнительная оценка эффективности извлечения фтора из воды (2,8 мг F–/дм3) при использовании следующих анионообменных смол в гидроксильной форме: Tulsion A’27, Lewatit MIH’59, Deaceodite FF’1P, Amberlite IRA’400 (11,66). Установлено, что обменная ёмкость повышается в указанном ряду слева направо и равна соответственно 32, 96, 130, 232 мг F–/дм3. Указанные значения снижаются при наличии в воде сульфатных, карбонатных и других анионов, конкурирующих с фтор-ионом (21). Процесс ионного обмена может быть эффективным только при концентрации фторида менее 10 мг/дм3.
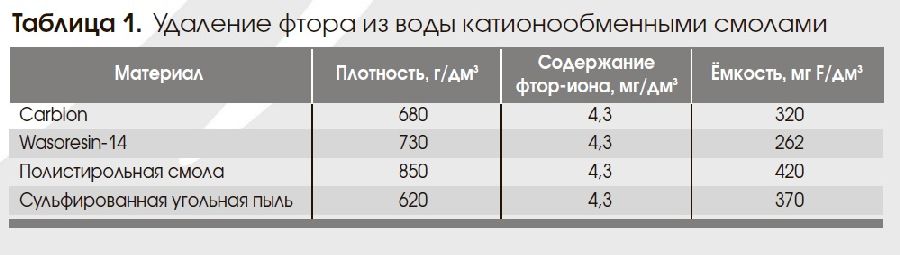
Катионообменные смолы, предварительно обработанные раствором сульфата (67-70) или оксихлорида (71) алюминия, также могут быть использованы в качестве дефторирующих материалов. Как видно из табл.1, обменная ёмкость таких загрузок несколько выше, чем в случае анионитов. Восстановление ионообменной способности фильтрующей загрузки проводится последовательной обработкой 1% раствором сульфата (11) или 2-4 % раствором основного хлорида (71) алюминия и водой. Для более эффективной регенерации рекомендована предварительная обработка катионита 1 М раствором соляной кислоты (70).
Несмотря на 90-95% удаление фтора, метод характеризуют: высокая себестоимость процесса из-за стоимости самого материала, его предобработки, регенерации, необходимости утилизации фтор обогащенных отходов; снижение эффективности очистки в присутствии конкурентно способных анионов; низкое рН очищенной воды и загрязнение её хлор-ионами. С учетом сказанного, использование ионообменных смол целесообразно при одновременном обессоливании и удалении избыточного фтора из воды (2, 4, 11).
■ ЭЛЕКТРОКОАГУЛЯЦИЯ
Электрокоагуляционное обесфторивание позволяет удалять фтор без применения химических реагентов, вместе с которыми в воду поступает значительное количество дополнительных солей, а благодаря формированию высоко активного гидроксида алюминия вследствие анодного растворения алюминиевых и дюралюминиевых электродов (4, 11, 14, 72-76). Для экономии энергозатрат варьируют токовой нагрузкой и расстоянием между электродами, электролиз ведут при постоянном или переменном токе. Идентичное количество гидроксида алюминия получается при электролизе 1 г алюминия или гидролизе 6,35 г сульфата алюминия. Основным фактором, влияющим на поглотительную способность электрохимически получаемого гидроксида алюминия, является рН, оптимальное значение которого по данным (14) колеблется в интервале 6,4-6,6. По данным (72) оптимальная область рН находится между 6 и 8. Обесфторивание методом электрокоагуляции, как и в случае применения алюминиевых коагулянтов, обусловлено формированием нерастворимых комплексов [Аl(ОН)3-xFx], состав которых установлен методом дифракции рентгеновских лучей (72).
Электрокоагуляционное обесфторивание было апробировано при очистке подземной воды в г. Бельцы (Молдова) и включало следующие стадии: предварительное подкисление (~рН 6,5), электрокоагуляция, отстаивание, фильтрация (14). При производительности электрокоагуляционной установки 3,6 м3/ч установлено, что для удаления 1 г фтора расход электроэнергии, металлического алюминия и кислоты равен соответственно 0,06-0,2 кВт»ч, 12 г и 0,2 дм3/м3. В очищенной воде (рН ~7,0-7,5) содержание остаточного алюминия и фтора не превышало ПДК для питьевой воды.
Положительные результаты были получены и при испытании полупромышленной установки по электрохимическому обесфториванию воды с начальным содержанием фтора 4-15 мг/дм3 (73). В отличие от (14, 72), предварительное подкисление соляной кислотой проводили до рН=4,5, поскольку при этом расход алюминия (10-14 г) и удельной энергии (0,1-0,2 кВт•ч) на грамм удаляемого фтора был наименьшим. при необходимой степени очистки. Обнаружено, что проведение электрокоагуляционного процесса при малых плотностях тока на электродах повышает не только эффект обесфторивания, но и снижает расход электроэнергии. За оптимальную величину принята плотность тока 10-20 А/м2, поскольку меньшие значения обусловливают увеличение размеров электролизера.
Определены оптимальные параметры процесса электрокоагуляционной очистки воды от ионов фтора в режиме циркуляции раствора (74): скорость циркуляции 200 дм3/ч; плотность тока 0,285 А/дм2, т.е. несколько выше, чем в (73). Проведенные испытания показали, что очистка воды (14-20 мг F/дм3) от фтор-иона до ПДК (1,0-1,2 мг/дм3) осуществляется за время циркуляции 30-40 мин. При этом расход алюминия и электроэнергии составляет соответственно 0,3 кг/дм3 и 2,0 кВт•ч/м3, рН меняется от 10-12 до 9-10.
Отличительной особенностью диафрагменного электролизера (14, 72) от рассмотренных выше является разделение поступающей на очистку воды на два потока: меньшая часть (10-15%) направляется в катодную камеру; большая (85-90%) – в анодную. В анодной камере происходит подкисление за счет электролиза воды (без дополнительного ввода кислых реагентов), насыщение ионами алюминия и формирование активного гидроксида алюминия. В воде, поступающей потребителю, содержание фтора не превышает 1,2 мг/дм3. Однако при этом не решен вопрос использования фторсодержащего раствора с повышенным рН в катодной камере, т.е. десятая часть воды сбрасывается в канализацию.
Проведены исследования процесса электрокоагуляции с использованием биполярных электродов при очистке как модельных, так и подземных вод с начальным содержанием 5-10 мгF–/дм3 в электролизерах периодического (75) и непрерывного (76) действия. Определены оптимальные эксплуатационные режимы: температура ~20ОС; рН в диапазоне 5-7,6; плотность тока 75 А/м2 и отношение полезной площади электродов к расходу очищаемой воды приблизительно 25 м2/м3. Необходимая степень очистки воды от фтор-ионов достигается при расходе металлического алюминия 17 г/г F (75).
Исследование влияния силы тока на процесс электрокоагуляции показало, что при токе в 60 А даже снижение расхода воды не обеспечивает требуемой очистки воды от фтор-ионов (76). При этом отмечено газовое выделение (электролиз воды), которое может быть использовано для отделения малорастворимого фторалюминиевого комплекса от очищаемой воды электрофлотацией (75, 76). Уменьшение тока до 40 и 25 А обеспечивает устойчивый режим процесса обесфторивания при расходе алюминия 13,5 г/г Р Таким образом, при наличии дешевой электроэнергии электролизер непрерывного действия с биполярными электродами может успешно применяться для глубокого обесфторивания небольших объёмов воды.
Положительные моменты применения электрокоагуляции при обесфторивании: простота технологической схемы; отсутствие складских помещений реагентов и аппаратуры для их приготовления (либо регенерации); довольно высокий эффект очистки. Значительный расход электроэнергии и металлического алюминия, а также быстрая пассивация электродов – основные недостатки данного метода.
■ МЕМБРАННЫЕ МЕТОДЫ:
ЭЛЕКТРОДИАЛИЗ, НАНОФИЛЬТРАЦИЯ, ОБРАТНЫЙ ОСМОС
Настоящее время – это период развития и широкого использования в различных сферах мембранных процессов первого поколения. Таковыми являются электродиализ (ЭД), ультрафильтрация (УФ) и нанофильтрация (НФ), обратный осмос (ОО). Основные характеристики мембранных процессов представлены в табл. 2 (77-97).
Электродиализ – это мембранный процесс обессоливания воды за счет разности электрического потенциала (77, 84-86). Между катодом и анодом помещается большое число катионо- и анионообменных мембран в чередующемся порядке (до несколько сот парных ячеек). Результат электродиализного обессоливания воды заключается в формировании концентрированного и очищенного растворов в разных чередующихся камерах. Количество переносимых ионов пропорционально плотности тока, которая ограничивается возникающей в процессе обессоливания концентрационной поляризацией (основной недостаток электродиализа). Мембраны, используемые при электродиализе, должны обладать высокой селективностью (катиону, аниону), электропроводностью, механической прочностью, а также умеренной степенью набухания.
Ультрафильтрация, нанофильтрация, обратный осмос- баромембранные процессы, отличающиеся размером разделяемых частиц растворенного вещества и, следовательно, структурой используемых мембран (табл. 2) (2, 4, 77-79, 81). Поскольку размер пор мембран, применяемых в перечисленных выше процессах, уменьшается слева направо, то в том же направлении, вследствие повышения сопротивления мембран массопереносу, растет прикладываемое рабочее давление. Если в процессе ультрафильтрации обеспечивается отделение от раствора макромолекулярных компонентов с молекулярной массой в несколько тысяч, то при нанофильтрации – нижний предел порядка нескольких сот. Обратный осмос применяется чаще всего для разделения воды от растворенных низкомолекуляр¬ных соединений. В баромембранных процессах, в основном, используются ассиметричные мембраны, в которых тонкий, относительно плотный верхний слой (толщиной 0,1-1,0 мкм) нанесён на подложку с пористой структурой (50-150 мкм). Поскольку гидравлическое сопротивление практически полностью локализуется в верхнем слое, то поток через такие мембраны обратно пропорционален его толщине (табл. 2).

Известно (77, 78, 81), что производительность УФ и НФ определяется, в основном, образованием пограничных слоёв на мембранах, поэтому для последних важным требованием является устойчивость к химическим реагентам, используемым для очистки. В то же время для мембран в ОО первостепенным является высокое сродство к растворителю (главным образом к воде) и низкая проницаемость для растворенного компонента.
Рассмотренные мембранные методы ранее практически не применялись для очистки (в частности, от ионов фтора) природных и подземных вод из-за высоких эксплуатационных расходов. Однако, вследствие повышения требований к качеству питьевой воды интерес к применению для обесфторивания воды ЭД, НФ и ОО в последнее время возрос.
В работе (80) представлены результаты очистки воды с общим солесодержанием около 3 г/дм3 и 3 мг F/дм3 методом электродиализа с химической предобработкой воды и без неё. Использован электродиализатор пакетного типа производительностью 150 м3/ч, состоящий из 10 пар катионо- (CMX и CMS) и анионоселективных (ACS и AFN) мембран, каждая из которых имела рабочую площадь 200 см2. Максимальные значения тока и напряжения равны соответственно 9,0 А и 10 В. Очистку осуществляли в два этапа длительностью соответственно 15 и 10 мин. Двухстадийный электродиализ обеспечивал: снижение солесодержания на 97,7%; остаточное содержание фтор-иона около 0,63 мг/дм3; расход энергии 0,808 кВт/кг удаленной соли; незначительное снижение рН очищенной воды с 6,5 до 5,7. В случае химической предобработки (карбонат и гидроксид натрия) электродиализ проводили в одну стадию в течение 35 мин через мембранную пару AFN-CMX. В целом эффективность процесса обессоливания и обесфторивания в этом случае составляла соответственно 91,5% и 73% при более низком расходе энергии 0,71 кВт/кг Экономически и экологически целесообразным, по мнению авторов (80, 84, 85), представляется использование электродиализа без химической предобработки для обесфторивания воды с повышенным солесодержанием.
Метод электродиализа был использован для очистки воды, солесодержание которой изменялось в интервале 2,1-4,8 г/дм3, с исходной концентрацией фторидов 5, 10, 15 и 20 мг/дм3 (83). Проведенные исследования и установленные оптимальные технологические параметры процесса свидетельствуют о перспективности использования данного метода для очистки солоноватой воды (до 5000 мг/дм3), содержащей до 15 мг/дм3 фтор-иона, который позволяет получить воду с концентрацией растворенных веществ и фторидов <600 мг/дм3 и <1,5 мг/дм3 соответственно. Расход электроэнергии при этом составляет не более 1 кВт/кг удаленных солей, что коррелирует с данными (80, 82).
Обесфторивание подземных вод электродиализом, как отмечают авторы (2, 4, 77, 79), экономически выгодно для стран Ближнего Востока, в которых питьевая вода, в отличие от западных стран, довольно дорогой продукт, тогда как энергия относительно дешевая.
Нанофильтрационные мембраны, которые характеризуются относительно невысокой задерживающей способностью по отношению к одновалентным ионам, могут успешно применяться для очистки воды от фтора, эффективно снижая его количество, но не задерживая полностью (4, 90, 91).
Проведены исследования по очистке воды с исходным содержанием фтор-иона от 1,5 до 20 мг/дм3 при использовании двух марок нанофильтрационных мембран: ESPA-1 (США, Hydranautics) c полигидразидным и ОПАМ-КН (Россия, НПО “Полимерсинтез”) с полиамидным разделительным слоем (87). Рабочее давление 1,0 и 1,5 МПа соответственно. Установлено, что при практически равной удельной производительности 23-25 дм3/м2ч коэффициент задержания F- для ESPA-1 на 25% выше, чем для ОПАМ-КН, и составляет 83%.
Количество фтора в пермеате на уровне 0,7-1,5 мг/дм3. Полученный ретентат предложено использовать для фторирования воды, в которой содержание фтора ниже 0,7 мг/дм3.
Много исследований посвящено изучению влияния давления, величины конверсии Y (отношение потока пермеата к исходному расходу воды), ионной силы, проницаемости мембран на коэффициент задержания F- ионов при нанофильтрационной очистке подземных вод (84-92). Изучение влияния давления в интервале 2-13 бар (Y=50% – const) на коэффициент задержания различных анионов одной валентности (F-, Cl-, I– и их смеси) при использовании мембраны DOW Chemical (США) (89, 90) показало, что минимальное количество фтор-иона в пермеате наблюдается при низком давлении (2-4 бар). Повышение давления увеличивает эффект задержания для ионов большего радиуса (С1-, I-), причём выход пермеата с ростом давления повышается больше для растворов, содержащих иодид, чем фторид, что свидетельствует о разных величинах осмотического давления. Повышение конверсии (р=const) приводит к снижению задержания всех анионов (89, 92).
Использование нанофильтрации при очистке подземной воды с исходным содержанием солей 2035 мг/дм3 и фтор-иона 13,5 мг/дм3 (юго-запад Сенегала) привело к снижению этих параметров соответственно до 230 мг/дм3 и 0,7 мг/дм3 и получению питьевой воды необходимого качества (91).
Авторы (87-92) считают, что при подготовке питьевой воды процесс нанофильтрации является конкурентно способным обратному осмосу и электродиализу, поскольку может отделить не только двухвалентные ионы (Ca2+,SO42- и т.д.), но и обеспечить при оптимальном режиме (давлении) селективное разделение ионов равной валентности, не приводя к полному обессоливанию воды. К преимуществам этой технологии следует отнести относительно малые эксплуатационные расходы и довольно дешевые с высоким сроком (5-6 лет) службы мембранные материалы (77, 78, 91).
Для очистки грунтовой воды с повышенным солесодержанием (железо, стронций, нитраты, фториды) и жёсткостью (81,94) технология обратного осмоса наиболее выгодна в сравнении с другими методами, поскольку обеспечивает высокий эффект очистки от ионо- и молекулярно-растворённых примесей. Основными факторами, влияющими на процесс обесфторивания воды методом ОО, являются её химический состав (в частности исходная концентрация F-), расход, рН, давление, температура и др. (77, 78, 93-97).
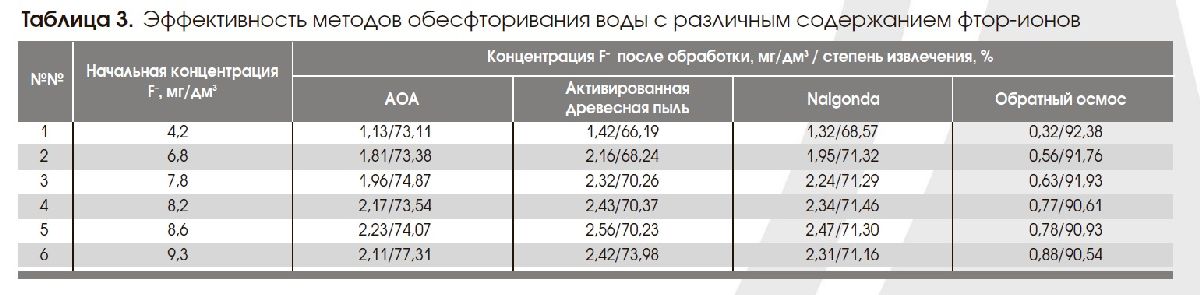
Проведены комплексные исследования по влиянию перечисленных выше параметров на эффект извлечения фтора до 1,0 мг/дм3 при исходном содержании 2,5-10 м F-/дм3 (93). В работе использовали тонкослойную полиамидную мембрану спиральной формы. Повышение давления с 0,5 до 5,0 бар приводит к увеличению степени очистки от фтор – иона с 82,0 до 92,6%. Более высокие значения этого параметра, а именно 5,0-10,0 бар, несмотря на некоторое улучшение эффективности процесса, нецелесообразны, поскольку, с одной стороны, приводят к резкому повышению расхода энергии, с другой – усиливают эффект уплотнения мембран, снижая срок их действия (93, 94). Увеличение расхода очищаемой воды с 6 до 24 дм3/ч обеспечивает рост эффективности удаления фтор-иона с 87 до 92,4% вследствие снижения концентрационной поляризации на поверхности мембраны. Зависимость степени извлечения F- от рН в интервале 3,5-8,0 носит ярко выраженный экстремальный характер с max при рН=7,0; Оптимальная температура процесса ОО около 25-30ОС, более высокие значения ухудшают очистку из-за повышения как растворимости, так и диффузии (95)). Повышение начальной концентрации F- в очищаемой воде с 2,5 до 10 мг/дм3, как и при использовании других методов обесфторивания (2, 4, 77, 80), снижает эффективность процесса обратного осмоса. Применение ОО при оптимальных условиях (давление 2 бар, рН=7,0, температура ~30ОС, расход 15 дм3/ч) для очистки реальной подземной воды из различных источников (СF=2,1–4,9 мг/дм3) позволяет не только снизить содержание данного элемента в среднем на 90,5%, но и значительно уменьшить солесодержание воды в целом (93).
Сравнительный анализ эффективности обесфторивания подземных вод различными методами (табл. 3), свидетельствует о значительном преимуществе обратного осмоса (82, 97).
Авторы (2, 4, 82, 93-97) отмечают следующие положительные моменты использования процесса обратного осмоса при водоподготовке: высокая эффективность удаления не только ионов фтора, но и различных неорганических и органических веществ, пестицидов, микроорганизмов; одновременная очистка и дезинфекция воды; отсутствие химических реагентов; работа в широком диапазоне рН; гарантированное постоянное качество воды; осуществление процесса в простом и автоматизированном операционном режиме с использованием компактной модульной системы при минимальных трудовых ресурсах; высокий срок работы мембран. Ограничения применения метода ОО: полное обессоливание воды, т.е. необходимость стабилизационной обработки очищенной воды не только по рН (кислая среда), но и по ряду солей; высокая стоимость в сравнении с другими методами обесфторивания; образование и переработка ретентата (соленая вода).
Таким образом, анализ известных в настоящее время методов обесфторивания воды свидетельствует о том, что ни один из них не является универсальным. Подтверждением этому является то, что ни один из методов обесфторивания не нашел крупномасштабного применения ни в одной стране мира.
В то же время любой из них может обеспечить удаление фтор-ионов из воды до требуемой кондиции, причём эффективность каждого метода будет определяться социально-географическими и экологическими условиями, присущими каждой стране, и её техническими и экономическими возможностями. Основными критериями, которыми следует руководствоваться при выборе метода обесфторивания, являются: стоимость и эффективность технологического процесса; качество конечного продукта – питьевой воды (по всем показателям, а не только по остаточному содержанию фтор-ионов). Определение этих характеристик возможно только в процессе апробации метода обесфторивания на фактической воде конкретного источника.
ЛИТЕРАТУРА:
1. Гончарук В.В, Жукинский В.Н., Чернявская А.П., Скубченко В.Ф. Разработка эколого-гигиенической классификации качества поверхностных вод Украины – источников централизованного питьевого водоснабжения // Химия и технология воды.- 2003. – 25, №2.- С.106-157.
2. Fawell J., Bailey K., Chilton J. et al. Fluoride in Drinking-water – Geneva: WHO, 2006. – 134 p.
3. Kass A., Yechieli Y, Gavrieli A. et al. The impact of freshwater and wastewater irrigation on the chemistry of shallow groundwater: a case study from the Israeli Coastal aquifer // J. Hydrol. – 2005. -300, № 1-4. – P. 314-331.
4. Meenakshi, Maheshwari R.C. Fluoride in drinking water and its removal // J. of HazardousMaterials. – 2006. – 137, №1. – P 456-463.
5. Золотова Е.Ф., Асс Г.Ю. Очистка воды от железа, марганца, фтора и сероводорода. М: Стройиздат, 1975. – 176 с.
6. Жовинский Э.Я., Крюченко Н.О. Полтавская фтороносная провинция // Вода і водоочисні технол. – 2003. – № 2. – С. 46 – 50.
7. Amina C., Lhadi L.K., Younsi A. et al. Environmental impact of an urban landfill on a coastal aquifer // J. Afr. Earth Sci. – 2004. – 39, № 3-5. – P.509-516.
8. Aldaco R. L., Irabien PA. Fluidized Bed Reactor for Fluoride Removal // Chemical Engineering Journal. – 2005. – 107, № 1-3. – P 113-117.
9. Anasuya A., Bapurao S., Paranjape PK. Fluoride and silicon intake in normal and endemic fluorotic areas // J. of Trace Elements in Medicine and Biology. – 1996. – 10. – P 149-155.
10. Dinesh C. Fluoride and human health-cause for concern // Ind. J. Environ. Protec. – 1998. – 19, № 2. – P 81-89.
11. Nagendra Rao C.R. Fluoride and environment // Proceedings of the Third International Conference on Environment and Health, Chennai, India, 15-17 December, 2003. – P 386 – 399.
12. Guidelines for drinking-water quality first addendum to third edition. Volume 1 Recommendations. – Geneva: WHO, 2006.
13. Qafas Z., Kacemi K.E., Edelani M.C. Study of the removal of fluoride from phosphoric acid solutions by precipitation of Na2SiF6 with Na2CO3 // Sci. Lett. – 2002. – 3, № 3. – P 1-11.
14. Николадзе ГИ. Улучшение качества подземных вод. М: Стройиздат, 1987.- 240 с.
15. Cengeloglu Y, Esengul K., Ersoz M. Removal of fluoride from aqueous solution by using bauxite wastes // Sep & Pur Tech. – 2002. – 28. – Р. 81 – 86.
16. Karthikeyan G., Muthulakshmi N., Saravana G. Defluoridation property of burnt clay // J. Indian Water Works Association- 1999. – 31. – p. 291- 295.
17. Reardon E.J., Wang Y. A limestone reactor for fluoride removal from wastewaters // Environ. Sci. Technol. – 2000. – 34. – P. 3247-3253.
18. Meenakshi, Garg VK., Renuka K. Ground water quality in some villages of Haryana, India: focus on fluoride and fluorosis // J. of Hazardous Materials.. – 2004. – 106.- P 85-97.
19. Susheela A.K. Fluorosis management programme in India // Curr. Sci. – 1999. – 77, № 10. – P 1250-1256.
20. Apparao B.V, Kartikeyan G. Permissible limits of fluoride on in drinking water in India in rural environment // Ind. J. Environ. Protec. – 1986. – 6, № 3. – P 172-175.
21. Veressinina Y, Trapido M., Anelik V, Munter R. Fluoride in drinking water. The problem and its possible solutions // Proc. Estonian Acad. Sci. Chem. – 2001. – 50, № 2. – P 81-88.
22. Kother M.C., Deutschman J.E., Vanloon G.W Low-cost polymeric aluminium coagulant // J. of Environmental Engineering, ASCE. – 1997. – Р 859 -864.
23. Sudhakar M. R., Mamatha P Water quality in sustainable water management // Current Sci..- 2004. – 87, №. 7. – Р 942-947.
24. Rivalta F. Technology to Remove Fluorides from Potable Water and Wastewater // M F P. – 2007. – 35. – P. 235-241.
25. Nayak P. P. Review aluminium: impacts and disease // Envtl. Res. Sec. – 2002. – 89.P. 101-115.
26. Meiying L., Yongbo S. Gongyeshui chuli // Ind. Water Treat. – 2003. – 23, № 7. – P. 39 -40.
27. Soumen D., Saswati G. Hydrous ferric oxide – a scavenger for fluoride from contaminated water // Water, Air and Soil Pollut.2004. – 158, № 1-4. – P. 311 – 323.
28. Прончева Л.Е., Левачева С.А. Применение оксида магния для фторирования и обесфторивания природных вод // Материалы 2 регион. межвуз. науч.-техн. кон- фер. – Вологда: ГТУ, 2001. – С. 159 – 160.
29. Raichur A.M., Basu M.J. Adsorption of fluoride onto mixed rare earth oxides // Sep. Purif. Technol. – 2001. – 24. – P. 121-127.
30. Mckee R., Johnston W.S. Removal of fluorides from drinking water using low-cost adsorbent // Ind. J. Environ. Health. – 1999. – 41, №.1. – P. 53-58.
31. Schoeman J.J., Macleod H. The effect of particle size and interfering ions on fluoride removal by activated alumina // Water SA. – 1987. – 13, №.4. – P. 229-234.
32. Hao O.J., Asce A.M., Huang C.P. Adsorption characteristics of fluoride onto hydrous alumina // J. of Environ. Eng. – 1986. – 112, № 6. – P. 1054- 1069.
33. Берендеева В.Л., Вахнин И.Г, Гороновский И.Т Использование активированного оксида алюминия А-1 для обесфторивания воды // Химия и технология .1985. – 7, №3. С. 87 – 88.
34. Lounici H., Belhocinea D., Grib H. et al. Fluoride removal with electro-activated alumina // Desalination. – 2004. – 161. – Р. 287-293.
35. Lounici H., Adour L., Belhocine D. et al. Novel technique to regenerate activated alumina bed saturated by fluoride ions // Chemical Engineering Journal. – 2001. -81.Р153-160.
36. Ku Y, Chiou H-M. The Adsorption of Fluoride Ion from Aqueous Solution by Activated Alumina // Water, Air, Soil Pollution. – 2002. – 133, №.1-4.- Р349-361.
37. Subhashini Ghorai, Pant K.K. Equilibrium, kinetics and breakthrough studies for adsorption of fluoride on activated alumina // Separation and Purification Technology 2005. – 42. – Р 265-271.
38. Shihabudheen M. Maliyekkal, Atul Kumar Sharma, Ligy P Manganese-oxide-coated alumina: A promising sorbent for defluori¬dation of water // Water Res. – 2006. – 40. P 3497 – 3506.
39. Das N., Pattanaik R, Das R. Defluoridation of drinking water using activated titanium rich bauxite // J. of Colloid and Interface Science. – 2005. – 292.- Р.1-10.
40. Тарасевич Ю.И. Современное состояние исследований в Украине в области химии поверхности, адсорбции и ионного обмена // Укр. хим. журн. – 2000. – 66, №9. – С.27-36.
41. Астрелин И.М., Артюх Ю.В., Толстопало- ва Н.М. и др. Исследование сорбционных процессов обесфторивания и обезжелезивания природных вод // Химия и технология воды.- 2000.- 22, №3. – С.310-315.
42. Высоцкая Е.В., Тарасевич Ю.И., Климова ГМ. и др. Синтез гидроксилапатитов и применение полученных материалов для извлечения ионов тяжелых металлов из водных растворов // Химия и технология воды.- 2002.- 24, № 6. – С.535-546.
43. Шкуткова Е.В., Тарасевич Ю.И. Применение гидроксилапатита для обесфторивания воды // Химия и технология воды.- 2004.- 26, № 6.- С.556-566.
44. Perrone J., Fourest B., Giffaut T. Surfase characterization and syntetic and mineral carbonate // Ibid. – 2002. – 249, № 2. – P. 441- 452.
45. Srimurali S., Pragathi A., Karthikeyan J. A study on removal of fluorides from drinking water by adsorption onto low-cost materials // J. Environ. Pollution. – 1998.- 99. – P. 285 – 293.
46. Larsen M.J., Pearce E.I., Jensen S.J. Defluoridation of water at high pH with use of brushite, calcium hydroxite, and bone char // J. of Dent. Res. – 1993. – 72, № 11. – P. 1519-1525.
47. Bo Y, Xinyun L. Weisheng yanjin // J. Hyg. Res. – 2001. – 30, № 4. – P. 244 – 246.
48. Тарасевич Ю.И. Физико-химические основы и технологии применения природных и модифицированных сорбентов в процессах очистки воды // Химия и технология воды. – 1998.- 20, № 1. – С.42 – 52.
49. Yang C.L., Dluh YR. Electrochemical generation of aluminium sorbent for fluoride adsorption // J. of Hazardous Materials. – 2002. – 94, № 3. – P 239-252.
50. Wang Hong-tao, Gi Gun-feng, lci Lian-wen. Yanshi kuangwuxue zazhi // Acta Petrol. Et Mineral. – 2003. – 22, № 1. – P.71-73.
51. Kau P.M.H., Smith D.W, Binning G.P. Experimental sorption of fluoride by kaolinite and bentonite. // Geoderma. – 1998. – 84.P 89-108.
52. Кравченко В.А., Кравченко Н.Д., Руденко ГГ, Тарасевич Ю.И. Обесфторивание природных вод с использованием клиноптилолита // Химия и технология воды.- 1990. – 12, № 7. – С. 647 – 649.
53. Матвієнко О.М. Знефторювання підземних вод на фільтрах з модифікованим завантаженням / Автореф. дис. канд. техн. наук. – Київ, 2006. – 18 с.
54. Diar-Nava C., Olguin M.T Water defluoridation by Mexican heulantide-clinoptilo- litr // Separ. Sci. and Technol. – 2002. – 37, № 13. – P 3109-3128.
55. Wang Y, Reardon E.J. Activation and regeneration of a soil sorbent for defluoridation of drinking water // Appl. Geochem. – 2001. – 16.- P 531-539.
56. Padmavathy S., Amali J., Raja R.E.et al. A study of fluoride level in potable water of Salem district and an attempt for defluoridation with lignite // Ind. J. Environ. Protec.2003. – 23, № 11. – P 1244-1247.
57. Zevenbergen C., Reeuwijk L.P, Frapporti G. et al. A simple method for defluoridation of water at village level by adsorption on Ando soil in Kenya // J. of International Society for Fluoride Research. – 1997. – 30, № 2. – P.128.
58. Sinha S., Pandey K., Mohan D. et al. Removal of Fluoride from Aqueous Solutions by Eichhornia crassipes Biomass and Its Carbonized Form // Ind. Eng. Chem. Res. – 2003. – 42, № 26. – P. 6911 -6918.
59. Singh R.P., Singh Y. Defluoridation of groundwater in Agra city using low cost adsorbents // Bull. Environ. Contam. And Toxicol. – 2000. – 65, № 1. – P. 120 – 125.
60. Слипченко В.А., Малицкая Т.Н., Бондаренко Н.А., Кисленко В.Л. Обесфторивание подземных вод гранулированным активным углем // Химия и технология воды. – 1984. – 6, №3.- С. 270-274..
61. Локшин Э.П., Беликов М.Л. Очистка воды от фторид-ионов соединениями титана // ЖПХ. – 2003. – 76, № 9.- С. 1505-1510.
62. Annouar S., Mountadar M. Defluoridation of underground water by adsorption on the chitosan and electrodialysis // Disalination. – 2004. – 165. – P. 437- 442.
63. Yaping Z., Xiu-yan l. Investigation of performances and mechanism of fluoride removal by Fe (111) – loaded ligand exchange cotton cellulose adsorbent // J. Natur Sci. – 2005. – 10, № 5. – P. 936-940.
64. Дебелый П., Новоженов С. Безреагентное обесфторивание подземных вод с помощью фильтрующей среды КДМ // Водоочистка. – 2005.- № 5. – С. 53 – 54.
65. Ensar O. Adsorption of fluoride on gas concrete materials // J. Hazardaes Mater. – 2005. – 117, № 2 – 3. – P. 227- 233.
66. Singh G., Kumar B., Sen P.K., Majumdar J. Removal of fluoride from spent pot liner leachate using ion exchange // Water Environ. Res. – 1999. – 71. – Р. 36 -42.
67. Castel C., Schweizer M., Simonnot M.O. et al. Selective removal of fluoride ions by a two-way ion-exchange cyclic process // Chem. Eng. Sci. – 2000. – 55. – P 3341 – 3352.
68. Sheng H. Lin, Jin M. Liu. Hydrofluoric Acid Recovery from Waste Semiconductor Acid Solution by Ion Exchange // J. Envir. Engrg.- 2003. – 129, № 5. – Р 472 – 478.
69. Mohan Rao N.V, Bhaskaran C.S. Studies on defluoridation of water // J. of Fluorine Chem. – 1988. – 41. – P. 17-24.
70. Самченко З.А., Гороновский И.Т, Вахнин И.Г Обесфторивание воды сульфостирольным Al-катионитом КУ-2 // Химия и технология воды. – 1985. – 7, №2. С. 77- 79.
71. Пат. 2220911 Россия, МПК7 С 02 F 1/28 / И.В.Никитин, А.М.Варламова, С.Е. Талтыкин. – Опубл. 10.01.2004.
72. M. Sivakumar M., Emamjomeh M.M. Speciation and Mechanisms of Defluoridation by an Electrochemical Method // Adv Techn. Environ. Field. – 2006. – 501. – Р 345-351.
73. Бычин Н.А., Сметанкина В.И. Испытание полупромышленной установки по электрохимическому обесфториванию воды // ВСТ. – 1978. – № 12. – С. 5 -7.
74. Кожемякин В.А., Градова Н.С., Почтарев А.Н. Электрокоагуляционная доочистка сточных вод от фтора // Цвет. металлы. – 1982. – № 7. – С.59 – 61.
75. Mameri N., Yeddou A.R., Lounici H., et al. Defluoridation of septentrional Sahara water of North Africa by electrocoagulation process using bipolar aluminium electrodes // Water Res. – 1998. – 32, № 5. – P 1604 – 1612.
76. Mameri N., Lounici H., Belhocine D. et al. . Defluoridation of Sahara water by small plant electrocoagulation using bipolar aluminium electrodes // Separ. Purif. Tec- hnol. – 2001. – 24. – Р113-119.
77. Мулдер М. Введение в мембранную технологию. – М.: Мир, 1999. – 513 с.
78. Дытнерский Ю.И. Баромембранные процессы. – М.: Химия, 1978. – 345 с.
79. Гребенюк В.Д., Пономарев М.И. Электромембранное разделение смесей. – Киев: Наукова думка, 1992. – 183 с.
80. Amor Z., Bariou B., Mameri N. et al. Fluoride removal from brackish water by electrodialysis // Desalination. – 2001. – 133. – P 215 – 223.
81. Pervov G.A., Dudkin E.V, Sidorenko O.A. NF membrane systems for drinking water production and their maintenance techniques // Desalination. – 2002. – 132. – Р 315 – 322.
82. Babra D., Caputi P, Cifoni D.S. Drinking water supply in Italy // Desalination. – 1997. – 113. – P 111-117.
83. Adhikari S.K., Tipnis U.K., Harkare W.P., Govindan K.P Defluoridation during desalination of brackish water by electrodialysis // Desalination. – 1989. – 71. – P 301-312.
84. Hichour M., Persin F., Gavach C. Fluoride removal from waters by Donann dialysis // Sep. Purif. Technol. – 2000. – 18. – P 1-11.
85. Hichour M., Persin F, Sandeaux J. et al. Water defluoridation by donann dialysis and electrodialysis // Rev Sci. Eau. – 1999. – 12. – P 671 – 686.
86. Garmes H., Persin F, Sadeaur J. et al. Def¬luoridation of groundwater by a hybrid process combining adsorption and Donnan dialysis // Desalination. – 2002. – 145. – P 287 – 291.
87. Балакіна М.М., Кучерук Д.Д., Головаш Е.А. Кондиціонування питної води з артезіанських скважин по фтору з використанням нанофильтраціі. // Метеріали Міжнарод. наук.-техн. конф. ” Розроблення та виробництво продуктів функціонального харчування, інноваційні технологи та конструювання обладнання для перероблення сільгоспсировини, культура харчування населення Украіни”. – Киів: НУХТ, 2004. – С.66 – 67.
88. Diey A., Mar C., Rumeau M. Les procetdets de detfluorurafion des eaux de boisson // Tribune l’eau. – 1994. – 568. – Р 27 – 34.
89. Lhassani A., Rumeau M., Benjelloun D., Ponfie M. Selective demineralisation of wafer by nanofilfrafion application fo the defluoridation of brackish wafer // Wafer Res. – 2001. – 35. – P 3260 – 3264.
90. Rumeau M. La nanofilfrafion: Principes, performances et application // Information chimie. – 1995. – 373. – P 1205 – 1210.
91. Rumeau M., Ponfiet M. Pofabilisafion d’une eau saumafre hyperfluoruree du Senegal par demineralisation selective // Hydrofop. Marseille. – 1998. – P21-23
92. Tanghe N., Kopp V, Dard S. ef al. Application of nanofilfrafion fo obtain drinking wafer // Euro membrane. – 1992. – 6. – P 67-72.
93. Arora M., Maheshwari R.C., Jain S.K. ef al. Use of membrane technology for potable wafer production // Desalination. – 2004. – 170. – P105 – 112.
94. Bal A.S. Characterization of NEERI made cellulose acetate reverse osmosis membrane // Ind. J. Environ. Health. – 1980. – 2. – Р 1-19.
95. Bouguecha S., Dhahbi M. The role of membrane technologies in supplying drinking and industrial wafer in Tunisia: Conventional process and new trends // Desalination. – 2002. – 151. – Р 75 – 86.
96. Wilf M., Klinko K. Effective new pre-treatment for seawater reverse osmosis systems // Desalination. – 1998. – 117. – Р 323-331.
97. Meenakshi, Maheshwari R.C., Jain S.K. A. Use of membrane technique for potable wafer production // Desalination. – 2004. – 170, № 2. – Р 105-112.